僕ら臨床工学技士にとって、貧血疾患というのは切っても切れません。
しかし、学校で習った覚えってありますか?
軽く造血については医学実習で習いましたが、どうでしょう?
もしかしたら臨床実習で嫌になるほど勉強した方も居るかもしれませんね。
では今一度、鉄代謝とは何か?を考えていければと思います。
検査項目は何があるのか?
体内の鉄の状態を調べる検査には4項目あり、メジャーな項目はその内の2項目になります。以下、項目の簡単な説明です。
- フェリチン(Ferritin) 正常値:男性20~250ng/mL , 女性10~80ng/mL
フェリチンは鉄結合性たんぱく質の一種であり、ほぼすべての生物が合成する。人においては鉄不足と鉄過剰を抑える役割を持つ。フェリチンはほとんどの組織の細胞質に存在するが、一部は細胞から漏れ出し、鉄運搬体として血漿中に認められる。血漿フェリチンの量は体内に蓄積されている鉄の総量の推測指標であり、鉄欠乏性貧血の診断材料である。
なお、ごく少量のトランスフェリンは結合しておらず、このトランスフェリンの事をアポフェリチンと呼ぶ。
- 血清鉄(Serum Iron以後、SI) 正常値:男性54~200ug/dL , 女性48~154ug/dL
血清鉄は血清中に存在する鉄の濃度。トランスフェリンと結合している。
- 総鉄結合能(Total Iron Binding Capacity : 以後、TIBC)
正常値:男性253~365ug/dL , 女性246~410ug/dL
この検査では、血清トランスフェリンが輸送できる最大量の鉄を測定する。実際、TIBCはトランスフェリンを反映しています。何故なら、血清サンプルに鉄を加えた後に測定できる鉄の量は、新たに血清中に加えられるトランスフェリン濃度に比例するからです。それでもなおその単位は鉄に換算されます。
- トランスフェリン飽和度%(Percent Transferrin Saturation:以後、TSAT)(ティーサット)
これは、血清鉄をTIBCで除することで計算でき、通常約30%(20~50%の幅)です1)。
$$TSAT = \frac{Fe}{TIBC} \times 100$$
これらの検査値を基に、これから先を説明していこうと思います。
吸収と排泄(ヘプシジンーフェロポルチンシステム)、分布
人体の中には、総量として3,000~4,000㎎の鉄が存在しています。
70%は赤血球内のヘモグロビンに結合してヘム鉄に、残りの30%がミオグロビン、電子伝達系、代謝酵素の補欠分子として利用されているか、肝臓などの網内系細胞に貯蔵されています。
ヒトが一日に食事からとる鉄は1~2mgとされています。これに対し、排泄も汗や粘膜、上皮細胞の剥離などで少量ですが1~2mgが失われます。但し、能動的な排泄機構は存在しないため、半閉鎖系で利用されています。
吸収機構
食事中に含まれる鉄は非ヘム鉄(Fe3+)として胃内へ入っていきますが、胃酸による低いpHで可溶化され、腸管上皮の腸管内腔側細胞膜に存在するduodenal cytochrome b (Dcytb)によって2価鉄に還元された後、金属トランスポーターであるdivalent metal transporter 1 (DMT1)という蛋白によって腸管上皮細胞に吸収されます。食肉などに含まれるヘム鉄(Fe2+)はheme carrier protein 1 (HCP1) という蛋白によって腸管上皮細胞に吸収されます。それぞれの吸収率は異なり、ヘム鉄と非ヘム鉄は10~30%、1~3%と言われています。一部の3価鉄は、食物内のビタミンCによって、2価鉄に還元されて吸収される機構も存在します。
吸収されたFeは共通の排出たんぱく質であるフェロポルチン(FPN)によって血管腔側に排出され、肝臓で合成されるトランスフェリン(Tf)により、骨髄を始めとした利用器官へ運搬される。Tf自体は金属イオンと非常に強く結合するが可逆的である。特に3価鉄との親和性は極度に高い。血漿中の鉄のほとんどがTfに結合しているが、全鉄量からするとわずか0.1%に過ぎず、鉄分貯蔵の意義はない。
抑制機構
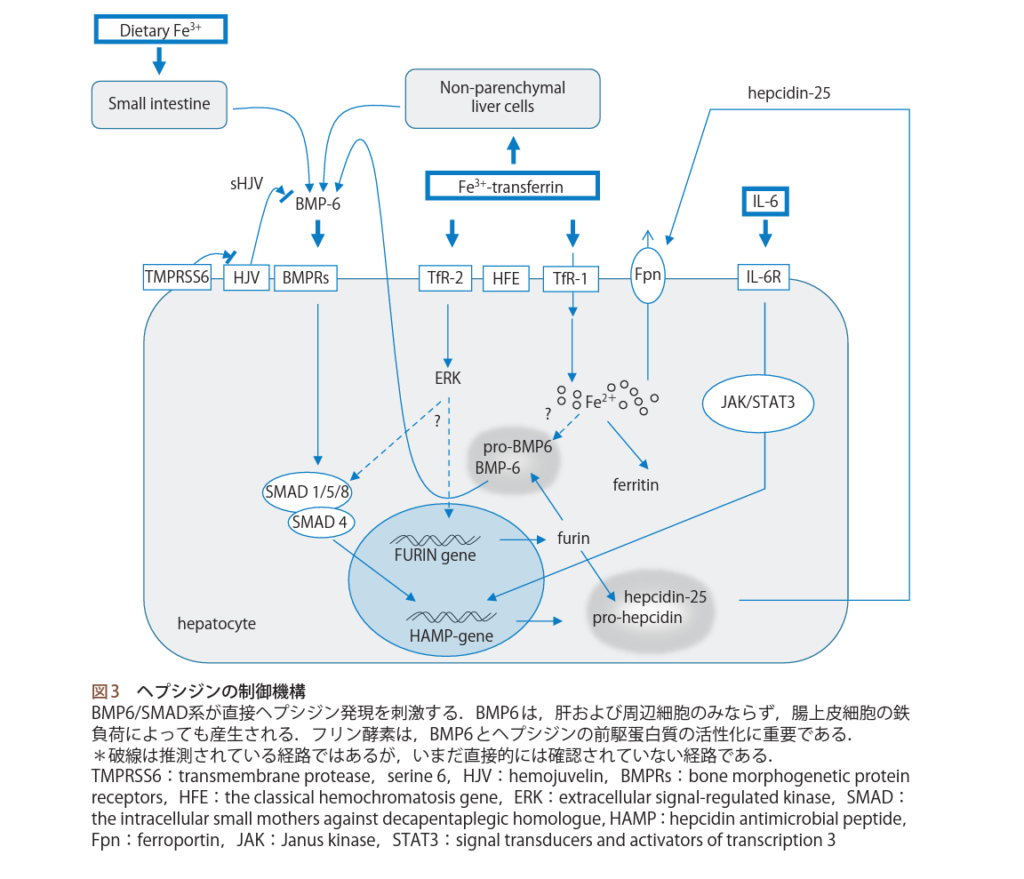
上記に反して、鉄には吸収を拮抗させる分子機構も存在する。それがヘプシジン(Hepcidin)-25である。
本来、Hbに結合していない鉄は全て血清中にTfと結合した状態で存在しており、それらはSIとして検査されます。SIの代わりに通常、TIBCが検査で用いられますが、先に説明したように、血清鉄/TIBC=TSATとなるが、TSATが高値(=SIが低値)になると、ヘプシジンの転写は亢進し、鉄の吸収や再利用を抑えるように肝細胞にシグナルを送る分子が発現します。これがトランスフェリンレセプター(Transferrin Receptor : 以後、TfR)2です。ヒトには2種類のトランスフェリン受容体があり、古典的なTfR1とTfR2の2種類が存在します。
TfR1は普段から大部分の細胞、特に発生中の赤血球でTfR1を介した鉄の取り込みが主要経路となっています。しかし、血清鉄濃度が低下すると、肝細胞上のTfR1の発現が増加するため、HFE※はTfR1と複合体をつくり、トランスフェリン鉄を取り込む方向へ働きます。逆に血清鉄が過剰になると、TfR1は発現が減少し、HFEはTfR2と複合体を作ります。
ではTfR2とは何か?TfR2は肝細胞膜上に発現を認め、TfR2は血清鉄濃度を監視しており、鉄過剰状態でHFEと複合体を形成しだす。TfR2のTfに対する結合親和性は25~30倍3)4)低いとされ、TfR1がその結合を飽和させることでTfR2に鉄Tfが結合を始める。その為普段複合体を作ることは少ない。トランスフェリンに結合したHFE-TfR2複合体はリン酸化され、シグナルが入る。このシグナルがフリン発現(図3)を増加させます5)。
一方では、肝細胞内の鉄量が増加すると骨形成蛋白質6(bone morphogenetic protein 6:以後BMP6)発現が増加し、前駆体がフリンで分解されBMP6が分泌され、BMP受容体に結合、リン酸化します。これが(the intracellular small mothers against decapentaplegic homologue:以後、SMAD)1/5/8をリン酸化し、SMAD4と結合し核内でペプシジン遺伝子(hepcidin antimicrobial peptide:以後、HAMP)のエンハンサー※2に結合し、転写を活性させる。
ヘプシジンの前駆体は前述したフリンによりヘプシジン-25に変換され分泌される。分泌されたヘプシジン-25は、マクロファージや腸上皮細胞や肝細胞の鉄輸送蛋白であるフェロポルチン(ferroportin:以後、FPN)の分布密度を制御して、血中への鉄供給量を制御している。
以上が鉄の吸収抑制機構の全容となります。
※脱線するが、HFEとはヘモクロマトーシス蛋白の事を指す。この遺伝子はヒトMHC class I様遺伝子で、その遺伝産物HFEは透析でお馴染みのβ2-MG、TfR1と結合する2)。
※2 遺伝学においてエンハンサーは、特定の遺伝子の転写の可能性を高めるためにタンパク質が結合する、短いDNA領域である。多くの場合、これらのエンハンサーに結合するタンパク質は転写因子と呼ばれる。
要約
3価鉄、および2価鉄は十二指腸、空腸上端で吸収されます。吸収された鉄は3価鉄としてTfに結合し、そのままTfR1を介して各種細胞、特に骨髄へ輸送される。老化した赤血球は脾臓のマクロファージで貪食され、その際に鉄は遊離し、再度Tfと結合し、体内を循環する。出血など、血清鉄が減少する場合にはTfR1の出現が亢進し、鉄を積極的に取り込む。Feが過剰な場合は、TfR2への結合がトリガーとなり、ヘプシジン-25が発現し、その結果FPNの発現密度を調整し、吸収を阻害する方向へ亢進する。
以上が要約となります。
あとがき
以上が鉄の代謝経路の説明となります。
相も変わらず、筆者の自己満足にお付き合いいただき、ありがとうございました。
実は上記は、呼吸で言う大循環を説明したに過ぎず、小循環である細胞内マトリクスは別に続きます。
が、mRNAだったりの話になるので割愛しようと思います。興味のある方は自己学習をば。
てなわけで本日もこの辺で。
ではでは~~
1)南学 正臣 , CKDブック 慢性腎臓病管理の手引 , 第26章p.312-313
2)高後 裕 , 消化器疾患の分子生物学 ヘモクロマトーシス , 分子消化器学(2004.12)1巻4号:343~349.
3)Transferrin receptor 2-alpha supports cell growth both in iron-chelated cultured cells and in vivo”. The Journal of Biological Chemistry 275 (22): 16618–25. (June 2000). doi:10.1074/jbc.M908846199. PMID 10748106.
4)omparison of the interactions of transferrin receptor and transferrin receptor 2 with transferrin and the hereditary hemochromatosis protein HFE”. The Journal of Biological Chemistry 275 (49): 38135–8. (December 2000).
5)Poli M, et al: Transferrin receptor 2 and HFE regulate furin expression via mitogen-activated protein kinase/ extracellular signal-regulated kinase(MAPK/Erk)signaling. Implications for transferrin-dependent hepcidin regulation. Haematologica 95: 1832―1840, 2010.



コメント